Samacheer Kalvi 9th Science Unit 13 Book Back Questions Tamil Medium with Answers:
Samacheer Kalvi 9th Standard New Science Book Back 1 Mark and 2 Mark Questions with Answers PDF uploaded and available below. Class 9 Science New Syllabus 2022 Unit 13 – வேதிப்பிணைப்பு Book Back Solutions available for both English and Tamil mediums. TN Samacheer Kalvi 9th Std Science Book Portion consists of 25 Units. Check Unit-wise and Full Class 9th Science Book Back Answers/ Guide 2022 PDF format for Free Download. Samacheer Kalvi 9th Science Unit 13 Tamil Medium Book back answers below:
English, Tamil, Maths, Science, and Social Science Book Back One and Two Mark Questions and Answers available in PDF on our site. Class 9th Standard Tamil Book Back Answers and 9th Science guide Book Back Answers PDF Tamil Medium. See below for the New 9th Science Book Back Questions with Answer PDF:
9th Samacheer Kalvi Science Book Back Answers in Tamil Medium PDF:
Tamil Medium 9th Samacheer Kalvi Science Book Subject One Mark, Two Mark Guide questions and answers are available below. Check 9th Science Chemistry questions for Tamil Medium and English Medium. Take the printout and use it for exam purposes.
அலகு 13: வேதிப்பிணைப்பு Book Back Answers in Tamil
Science (அறிவியல்)
அலகு 13 – வேதிப்பிணைப்பு
I. சரியான விடையைத் தேர்ந்தெடு:
1. கார்பன் அணுவில் உள்ள இணைதிறன் எலக்ட்ரான்களின் எண்ணிக்கை
அ) 2
ஆ) 4
இ) 3
ஈ) 5
விடை: ஆ) 4
2. சோடியத்தின் அணு எண் 11 அது ……………. நெருக்கமான மந்த வாயுவின் நிலையான எலக்ட்ரான் அமைப்பைப் பெறுகிறது.
அ) ஒரு எலக்ட்ரானை ஏற்று
ஆ) இரண்டு எலக்ட்ரான்களை ஏற்று
இ) ஒரு எலக்ட்ரானை இழந்து
ஈ) இரண்டு எலக்ட்ரான்களை இழந்து
விடை : இ) ஒரு எலக்ட்ரானை இழந்து
3. வேதிவினைகளில் எலக்ட்ரான்களை ஏற்று எதிர் அயனியாக மாறக்கூடிய தனிமம்
அ) பொட்டாசியம்
ஆ) கால்சியம்
இ) புளூரின்
ஈ) இரும்பு
விடை : இ) புளூரின்
4. உலோகங்களுக்கும் அலோகங்களுக்கும் இடையே தோன்றும் பிணைப்பு ……………………
அ) அயனிப்பிணைப்பு
ஆ) சகப் பிணைப்பு
இ) ஈதல் சகப் பிணைப்பு
விடை :
அ) அயனிப்பிணைப்பு
5. ……………. சேர்மங்கள் அதிக உருகுநிலை மற்றும் கொதிநிலை கொண்டவை
அ) சகப்பிணைப்பு
ஆ) ஈதல் சகப்பிணைப்பு
இ) அயனிப் பிணைப்பு
விடை : இ) அயனிப்பிணைப்பு
6. சகப்பிணைப்பு ………………. மூலம் உருவாகிறது.
அ) எலக்ட்ரான் பரிமாற்றத்தின்
ஆ) எலக்ட்ரான் பங்கீடு
இ) ஒரு இணை எலக்ட்ரான்களின் பங்கீடு
விடை : ஆ) எலக்ட்ரான் பங்கீடு
7. ஆக்ஸிஜனேற்றிகள் ……………. எனவும் அழைக்கப்படுகின்றன.
அ) எலக்ட்ரான் ஈனி
ஆ) எலக்ட்ரான் ஏற்பி
விடை : ஆ) எலக்ட்ரான் ஏற்பி
8. வெளிக்கூட்டில் எட்டு எலக்ட்ரான்களுடன் நிலைத்த எலக்ட்ரான் அமைப்பைப் பெற்ற தனிமங்கள் ……………….
அ) ஹேலஜன்கள்
ஆ) உலோகங்கள்
இ) மந்த வாயுக்கள்
ஈ) அலோகங்கள்
விடை : இ) மந்த வாயுக்கள்
II. சுருக்கமாக விடையளி:
1. தனிமங்கள் எவ்வாறு மந்த வாயுக்களின் எலக்ட்ரான் அமைப்பிற்கு மாறுகின்றன?
விடை :
- மந்த வாயுக்கள் தவிர மற்ற தனிம அணுக்கள் முழுவதும் நிரப்பப்படாத இணைதிறன் கூட்டைப் பெற்றிருக்கின்றன.
- ஒரு அணு அதன் இணைதிறன் எலக்ட்ரான்களை இழந்து அல்லது பங்கீடு செய்து இணைவதன் மூலம் நிலையான மந்த வாயுக்களின் எலக்ட்ரான் அமைப்பைப் பெறுகின்றன.
2. CCL4 நீரில் கரைவதில்லை . ஆனால் NaCl நீரில் கரைகிறது, காரணம் கூறு.
விடை :
- CCl4 : கார்பன் டெட்ரா குளோரைடு ஒரு முனைவற்ற சகப்பிணைப்பு மூலக்கூறு ஆகும்.
- சகப்பிணைப்பு சேர்மங்கள் நீர் (H2 O) போன்ற முனைவுள்ள கரைப்பான்களில் இவை எளிதில் கரைவதில்லை.
- NaCl: சோடியம் குளோரைடு ஒரு அயனி மூலக்கூறு ஆகும்.
- அயனிச் சேர்மங்கள் நீர் போன்ற முனைவுள்ள கரைப்பான்களில் கரையக் கூடியன.
3. எண்ம விதியை எடுத்துக்காட்டுடன் கூறுக.
விடை :
- எண்ம விதி: ஒரு அணுவானது மற்றொரு அணுவிடம் அதன் இணைதிறன் கூடு எலக்ட்ரான்களை இழந்தோ (அல்லது) பங்கீடு செய்தோ இணைதிறன் கூட்டில் 8 எலக்ட்ரான்களைப் பெற்றிருக்கும் விளைவு எட்டு (8) எலக்ட்ரான் விதி (அ) எண்ம விதி ஆகும். உம்.
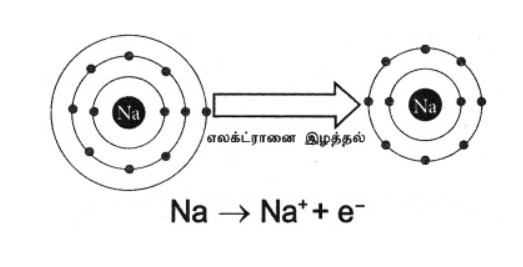
- சோடியத்தின் (Na) அணு எண் 11 மற்றும் எலக்ட்ரான் அமைப்பு 2, 8, 1
- Na அதன் இணைதிறன் கூட்டிலிருந்து ஒரு எலக்ட்ரானை எளிதில் இழந்து நியான் Ne – அணுவின் எலக்ட்ரான் அமைப்பை 2, 8பெறுகிறது.
4. பிணைப்பின் வகைகள் யாவை?
விடை :
அயனிப் பிணைப்பு :
- அணுக்கள் நிலையான அமைப்புப் பெற எலக்ட்ரான்களை இழக்கவோ அல்லது ஏற்கவோ செய்யலாம்.
- எலக்ட்ரான்களை ஏற்கும் போது அவை எதிர்மின் அயனி.
- எலக்ட்ரான்களை இழக்கும் போது அவை நேர்மின் அயனி.
சகப்பிணைப்பு :
- இரு அணுக்கள் சமமாக எலக்ட்ரான்களைப் பங்கீடு செய்து அவற்றிற்கிடையே உருவாகும் பிணைப்பு சகப்பிணைப்பு எனப்படுகிறது.
ஈதல் சகப்பிணைப்பு :
- சில சேர்மங்களில் சகப்பிணைப்பு உருவாக்கத் தேவையான இரு எலக்ட்ரான்களையும், பிணைப்பில் ஈடுபடும் ஏதேனும் ஒரு அணு வழங்கிப் பிணைப்பை உருவாக்குகிறது. இது ஈதல் சகப்பிணைப்பு எனப்படும்.
5. தவறான கூற்றைக் கண்டறிந்து அவற்றைச் சரி செய்க.
விடை :
அ) அயனிச் சேர்மங்கள் முனைவற்ற கரைப்பான்களில் கரையும்.
ஆ) சகப்பிணைப்புச் சேர்மங்கள் உருகிய நிலையிலும், கரைசல் நிலையிலும் மின்சாரத்தைக் கடத்தும். விடைகள்.
அ. அயனிச் சேர்மங்கள் முனைவுள்ள கரைப்பான்களில் கரையும்.
ஆ. அயனிச் சேர்மங்கள் உருகிய நிலையிலும், கரைசல் நிலையிலும் மின்சாரத்தைக் கடத்தும்.
6. சரியாகப் பொருந்துவதைத் தேர்ந்தெடு
விடை :
அயனிச் சேர்மங்களின் பொதுவான பண்புகள்
அ) இவை அறை வெப்பநிலையில் வாயுக்கள்
ஆ) இவை கடினமான மற்றும் நொறுங்கும் தன்மை கொண்டவை.
இ) இவை மூலக்கூறு வினைகளுக்குட்படுகிறது,
ஈ) இவற்றின் உருகுநிலை குறைவு.
விடை :
ஆ) இவை கழனமான மற்றும் நொறுங்கும் தன்மை கொண்டவை.
7. கீழ்க்கண்ட வினைகள் ஆக்ஸிஜனேற்ற ஒடுக்க வினைகளா எனக் காண்க.
அ) Na → Na+ + e–
ஆ) Fe3+ + 2e– → Fe+
விடை : அ) ஆக்ஸிஜனேற்றம்
ஆ) ஒடுக்கம்
8. கொடுக்கப்பட்ட பண்புகளின் அடிப்படையில் சேர்மங்களின் வகையைக்
கண்டறிக. (அயனி / சக / ஈதல் சகப்பிணைப்பு)
அ) முனைவற்ற கரைப்பான்களில் கரையும்
ஆ) வினையின் வேகம் மிக அதிகம்
இ) மின்சாரத்தைக் கடத்துவதில்லை
ஈ) அறை வெப்பநிலையில் திண்மங்கள்
விடை :
அ) சகப்பிணைப்பு, ஈதல் சகப்பிணைப்பு ஆ) அயனிப்பிணைப்பு
இ) சகப்பிணைப்பு, ஈதல் சகப்பிணைப்பு ஈ) அயனிப்பிணைப்பு
9. மந்த வாயுக்கள் ஏன் மந்தத் தன்மையுடன் காணப்படுகின்றன?
விடை:
- மந்த வாயு அணுக்கள் முழுவதும் நிரம்பிய இணைதிறன் கூட்டைப் பெற்றுள்ளது.
- இணைதிறன் கூட்டில் நிலையான எலக்ட்ரான் அமைப்பைப் பெற்றிருப்பதால் அவை எலக்ட்ரான்களை இழக்கும் (அ) ஏற்கும் தன்மையைப் பெற்றிருப்பதில்லை.
- எனவே அவற்றின் இணைதிறன் 0 (பூஜ்ஜியம்)
III. விரிவாக விடையளி:
1. கீழ் உள்ள கூற்றுகள் ஒவ்வொன்றிற்கும் ஓர் எடுத்துக்காட்டு தருக.
அ) இரண்டு சகப்பிணைப்பு உள்ள ஒரு சேர்மம்.
ஆ) ஒரு அயனிப் பிணைப்பு உள்ள ஒரு சேர்மம்.
இ) இரண்டு சகப்பிணைப்பும், ஒரு ஈதல் சகப்பிணைப்பும் உள்ள ஒரு சேர்மம்.
ஈ) மூன்று சகப்பிணைப்பு உள்ள ஒரு சேர்மம்.
விடை :
அ) O2 (O = O)
ஆ) NaCl (Na+ Cl–)
இ) CO (C = 0)
ஈ) N2 (N = N)
2. தவறான கூற்றைக் கண்டறிந்து சரி செய்க.
அ) சகப்பிணைப்புச் சேர்மங்களைப் போலவே, ஈதல் சகப்பிணைப்புச் சேர்மங்களும் மின் சுமை கொண்ட (அயனிகள்) துகள்களைப் பெற்றுள்ளன. எனவே அவை நல்ல மின்கடத்திகள்
விடை:
தவறு
சகப்பிணைப்புச் சேர்மங்களைப் போலவே, ஈதல் சகப்பிணைப்புச் சேர்மங்களும் மின்சுமை அற்ற (அயனிகள்) துகள்களைப் பெற்றுள்ளன.
எனவே அவை அரிதில் மின்கடத்திகள் ஆகும்.
ஆ)ஹைட்ரஜன் பிணைப்புடன் ஒப்பிடும் போது அயனிப் பிணைப்பு வலிமை குறைந்த பிணைப்பு ஆகும்.
விடை:
தவறு
ஹைட்ரஜன் பிணைப்புடன் ஒப்பிடும்போது அயனிப் பிணைப்பு வலிமை மிகுந்த பிணைப்பு ஆகும்.
இ) அயனிப் பிணைப்பு எலக்ட்ரான்களை சமமாக பங்கீடு செய்வதால் உருவாகிறது.
விடை:
தவறு
சகப் பிணைப்பு எலக்ட்ரான்களை சமமாக பங்கீடு செய்வதால் உருவாகிறது.
ஈ) எலக்ட்ரான் இழப்பு ஆக்ஸிஜனேற்றம் என்றும், எலக்ட்ரான் ஏற்பு ஒடுக்கம் என்றும் அழைக்கப்படுகிறது.
விடை:
சரி
உ) பிணைப்பில் ஈடுபடாத எலக்ட்ரான்களை இணைதிறன் எலக்ட்ரான்கள் என்கிறோம்.
விடை:
தவறு
பிணைப்பில் ஈடுபடும் எலக்ட்ரான்களை இணைதிறன் எலக்ட்ரான்கள் என்கிறோம்.
3. ஈதல் சகப்பிணைப்புச் சேர்மங்களின் பண்புகளை விவரி.
விடை:
- இயற்பியல் தன்மை : வாயுநிலை, நீர்மநிலை மற்றும் திண்மநிலையில் உள்ளன.
- மின்கடத்துத் திறன்: இச்சேர்மங்களில் அயனிகள் இல்லை. எனவே இவை அரிதில் மின்கடத்திகள் ஆகும்.
- உருகுநிலை: இச்சேர்மங்களின் உருகுநிலை மற்றும் கொதிநிலை சகப்பிணைப்புச் சேர்மங்களை விட அதிகமாகவும் அயனிச்சேர்மங்களை விட குறைவாகவும் உள்ளன.
- கரைதிறன்: நீர் போன்ற முனைவுள்ள கரைப்பான்களில் மிகச்சிறிதளவே கரையும் (அ) கரைவதில்லை. பென்சீன்.
- டொலுவீன், கார்பன் டெட்ரா குளோரைடு போன்ற முனைவற்ற கரைப்பான்களில் எளிதில் கரைகிறது.
- வினைபடுதிறன்: மெதுவான மூலக்கூறு வினைகளில் ஈடுபடுகின்றன.
4. பின்வரும் சேர்மங்களில் உள்ள குறிப்பிட்ட தனிமத்தின் ஆக்ஸிஜனேற்ற எண்ணைக் கணக்கிடுக.
அ) CO2 ல் உள்ள C
ஆ) MnSO4 ல் உள்ள Mn
இ) HNO3 ல் உள்ள N
விடை :
அ) கார்பனின் (C) ஆக்சிஜனேற்ற எண் = X
ஆக்சிஜனின் (O2) ஆக்சிஜனேற்ற எண் = -2
C + O2 = 0
X + 2 (-2)
= 0
X – 4 = 0
ஃ X = + 4
C – யின் ஆக்ஸிஜனேற்ற எண் = 4
இ) H – ஆக்சிஜனேற்ற எண் = + 1
O – ஆக்சிஜனேற்ற எண் = -2
N – ஆக்சிஜனேற்ற எண் = x
+ 1 + x + 3 (-2) = 0
+ 1 + x – 6 = 0
x – 5 =0
x = + 5
N – ன் ஆக்சிஜனேற்ற எண் = + 5
ஆ) Mn – ஆக்சிஜனேற்ற எண் = X
S – ஆக்சிஜனேற்ற எண் = 6
O4 – ஆக்சிஜனேற்ற எண் = -2
Mn + S + O4 = 0
X + 6 + (-2 x 4) = 0
X + 6 + (-8) = 0
X – 2 = 0
ஃ X = +2
Mn – ன் ஆக்சிஜனேற்ற எண் = 2
Other Important links for 9th Science Book Back Answers in Tamil:
Click Here to Download Samacheer Kalvi 9th Science Book Back Answers in Tamil – 9th Science Book Back Answers in Tamil
